Prof.Dr.Luis Carlos Figueira de Carvalho
Flavonoides
- GENERALIDADES
Os flavonoides, biossintetizados a partir da via dos fenilpropanóides, constituem uma importante classe de polifenóis, presentes em relativa abundância entre os metabólitos secundários de vegetais. Uma “substância fenólica ou polifenólica” é aquela que possui um ou mais núcleos aromáticos contendo substituintes hidroxilados e/ ou seus derivados funcionais (ésteres, éteres, glicosídeos e outros). Entretanto, uma definição levando em conta somente a estrutura química não é apropriada, uma vez que existem compostos contendo hidroxilas fenólicas, que fazem parte de outras classes de metabólitos. Dessa forma, é mais conveniente empregar-se uma definição que leva em conta também a origem biogenética.
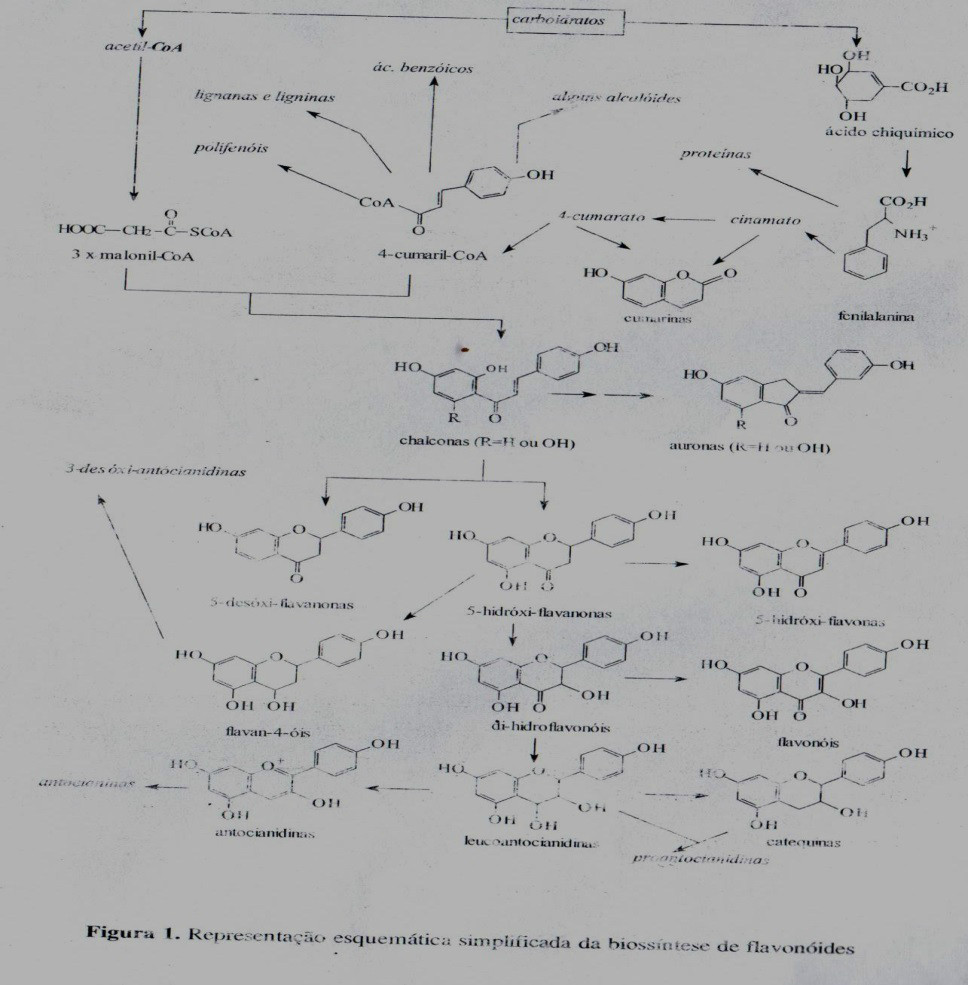
Uma representação esquemática da biossíntese de flavonoides está apresentada na figura 1. Os nomes triviais dos flavonoides empregados possuem, na grande maioria dos casos, relação com a planta na qual foram identificados pela primeira vez. Por exemplo: tricina foi isolada de Triticum sp., rabinetina de Robinia sp., vitexina de Vitex sp. e quercetina de Quercus sp. e quercetina de Quercus sp. A grande diversidade de nomes triviais destas substâncias pode causar uma certa confusão para os indivíduos ainda não familiarizados com este tipo de nomenclatura.
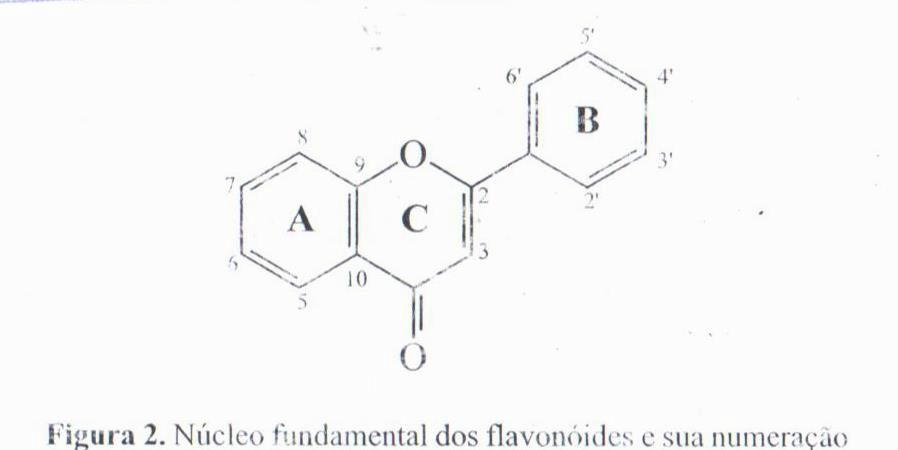
Podem-se encontrar flavonoides em diversas formas estruturais. Entretanto, a maioria dos representantes dessa classe possui 15 átomos de carbono em seu núcleo fundamental, constituído de duas fenilas ligadas por uma cadeia de três carbonos entre elas. Nos compostos tricíclicos, as unidades são chamadas núcleos A,B e C e os átomos de carbono recebem a numeração com números ordinários para os núcleos A e C e os mesmos números seguidos de uma linha (‘) para o núcleo B (figura 2). Alguns autores substituem a numeração 9 e 10 nos flavonóides por 8ª e 4ª, respectivamente. As chalconas, excepcionalmente, possuem uma numeração diferente, como apresentado no item correspondente a seguir.
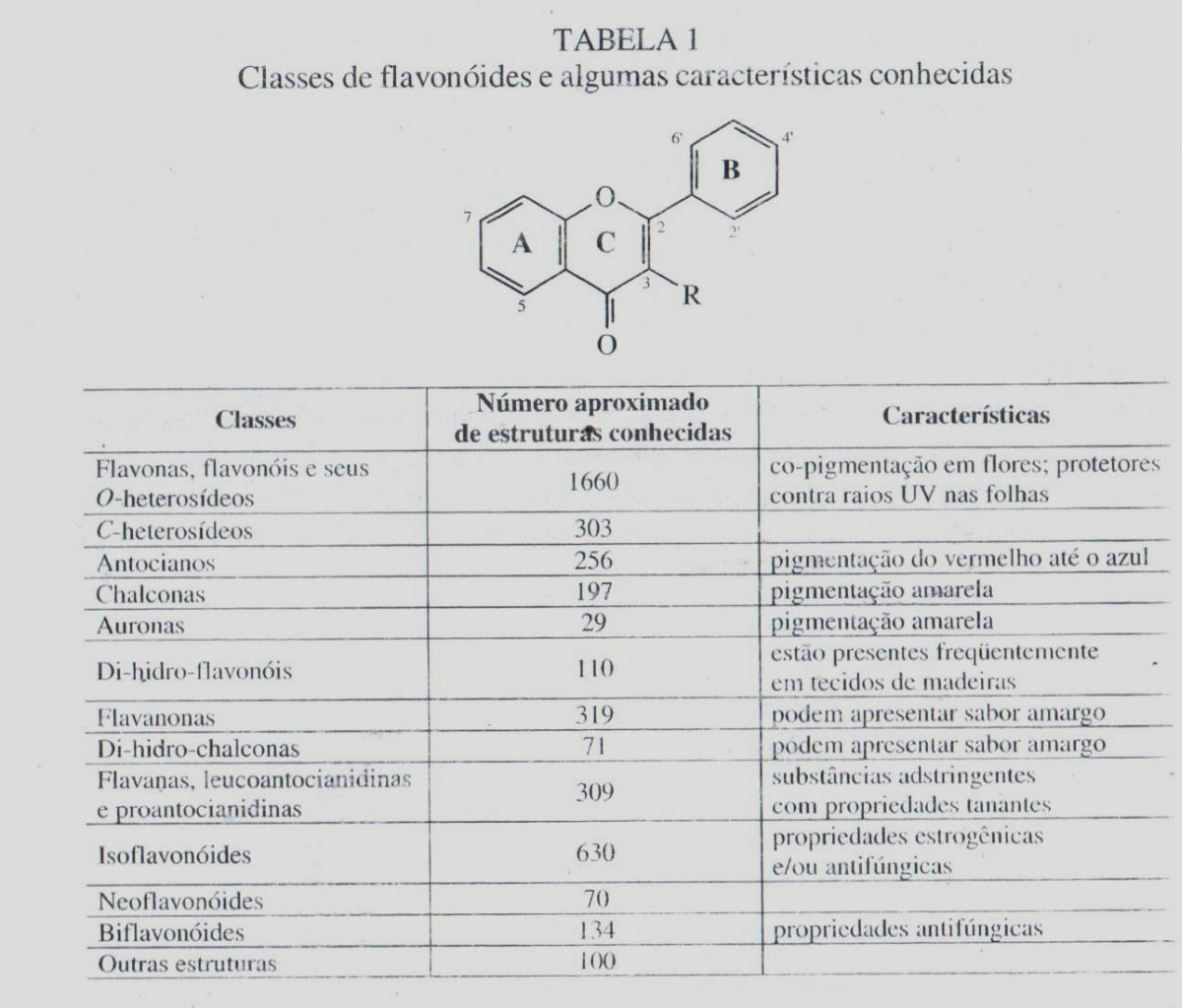
São conhecidos, até o presente, mais de 4.200 flavonoides diferentes, sendo que o número de novas estruturas identificadas praticamente dobrou nos últimos vinte anos. Os flavonoides de origem natural apresentam-se, frequentemente, oxigenados e um grande número ocorre conjugando com açúcares. Essa forma, chamada conjugada, também é conhecida como heterosídeo. São denominados de O-heterosídeos quando a ligação se dá por intermédio de uma hidroxila e de C-heterosídeos quando a ligação se dá com um átomo de carbono. Quando o metabólito (flavonoides, antraquinonas, terpenos, etc.) encontra-se sem o açúcar, é chamado de aglicona ou genina, sendo frequentemente denominado de forma livre. Na tabela 1 estão apresentadas as principais classes de flavonoides e um resumo de suas propriedades biológicas mais importantes.
- FLAVONAS, FLAVONÓIS E SEUS O-HETEROSÍDEOS
Esses compostos fazem parte de um grande grupo de flavonoides de origem biossintéticas muito próximas. Como os flavonóis são flavonas substituídas na posição C-3 por uma hidroxila, essas duas classes são em geral classificadas juntas. Isto é justificado um vez que suas análises, síntese e reações químicas possuem uma base teórica comum.
Suas cores variam do branco ao amarelo, sendo identificados em quase todo reino vegetal. As flavonas e flavonóis naturais frequentemente oxigenados, substituídos com hidroxilas e/ou metoxilas. Outros substituintes encontrados com bastante frequência são: acila, C-metila, metileno, dioxila, isopreno, pirano, furano e seus derivados clorados. A maioria das flavonas e flavonóis identificados em plantas estão sob forma conjulgada, i.e., com um ou mais açúcares ligados aos grupos hidroxilas por uma ligação hemiacetal facilmente destruída por hidrólise ácida. Além disso, existem formas desses flavonoides possuindo um ou mais sulfatos ligados à hidroxila e/ou à parte osídica da molécula. Alguns flavonoides têm sido identificados com ácidos ligados aos açúcares da molécula. As flavonas e flavonóis mais comuns estão apresentados na tabela 2.

- FLAVONÓIDES C-HETEROSÍDEOS
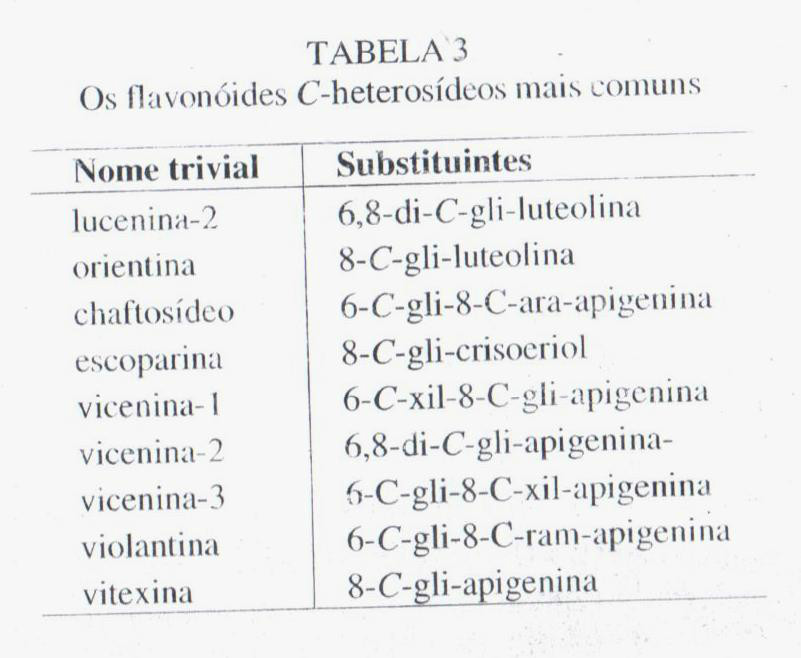
Os flavonoides C-heterosídeos são diferenciados dos O-heterosídeos pela ligação açúcar-genina, sendo que nos primeiros a ligação é feita entre o carbono C-1 (anomérico) do açúcar e um ou dois carbonos do anel A do flavonóide (sempre nos carbonos 6 e/ou 8). O sistema de numeração é o mesmo empregado para os O-heterosídeos. Na tabela 3 estão apresentados alguns representantes desta classe. Sua principal característica química é a resistência à hidrólise ácida. Além dos C-heterosídeos de flavonas, ou mais abundantes, foram identificados ainda em: flavanonas, flavanóis e proantacianidinas. Também estão presentes em plantas em formas derivadas O-acilas e O-heterosídeos.
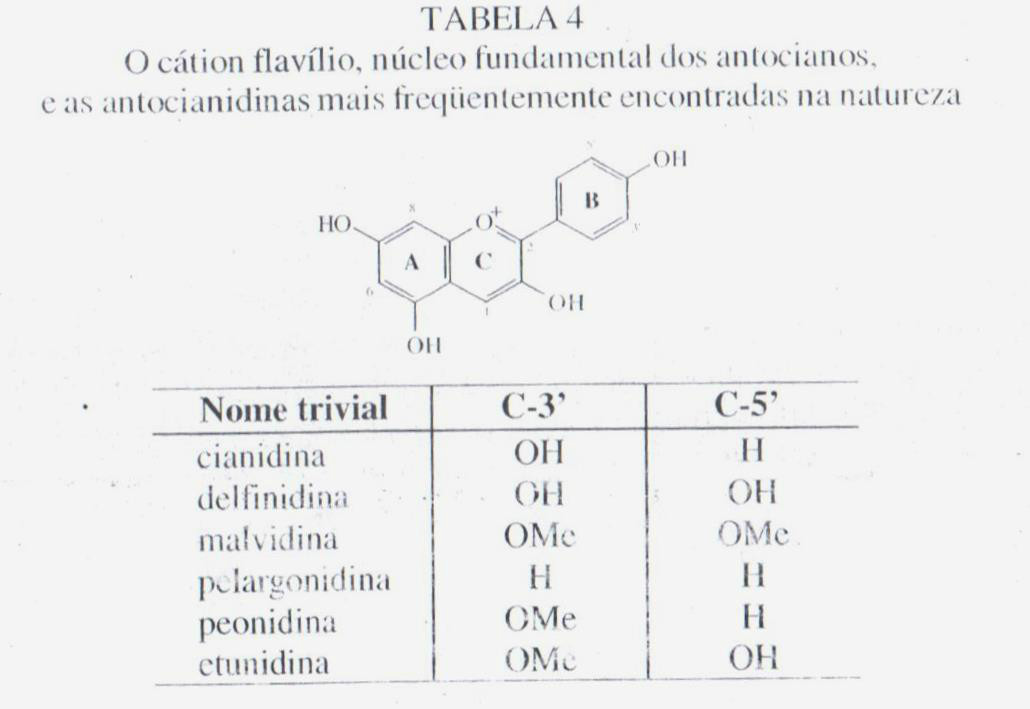
- ANTOCIANOS
Antociano é um termo empregado originalmente para descrever os pigmentos azuis de Centaurea cyanus L. É um dos mais importantes grupos de pigmentos de plantas solúveis em água, ao lado de betaínas (também hidrossolúveis) e dos carotenos (geralmente hidrofóbicos).
Os antocianos, distribuídos em diversas famílias vegetais, são em grande parte responsáveis pelas cores laranja, rosa, escarlate, vermelho, violeta e azul das pétalas de flores e frutos de vegetais superiores. Também são encontrados em outros órgãos de planta como as raízes e folhas. Uma das mais importantes funções dos antocianos é de agir como atraentes de insetos e de pássaros, com o objetivo de polinizar e dispersar as sementes, sendo assim de grande interação entre plantas e animais. Também são responsáveis pela atividade inibidora do crescimento de larvas de alguns insetos.
- CHALCONAS
O termo chalcona é utilizado para caracterizar uma família de compostos possuindo como núcleo fundamental o 1,3-diarilpropano, modificado pela presença de uma ligação alefínica, de um grupamento cetona e/ou de um grupo hidroxila. Nessa classe, o núcleo A é numerado com números ordinários seguidos de uam linha (‘) e o B com números ordinários (tabela 5), contrariamente à maioria dos outros flavonoides. Isso é devido ao fato de que as primeiras chalconas identificadas foram comparadas às acetofenonas, às quais é empregado este sistema de numeração.
As chalconas são compostos precursores da via de biossíntese dos flavonoides. Uma característica marcante neste grupo, também verificada em auronas, é a de apresentar pigmentação amarela que passaa vermelha em meio alcalino. Chalconas e auronas são identificadas em geral nas mesmas plantas, tendo um papel importante em sistemas ecológicos em função das cores que produzem nos vegetais. As cores estão implicadas na polinização como atraentes de insetos e/ou pássaros. Alguns representantes de chalconas estão apresentados na tabela 5.

- AURONAS
O termo aurona foi proposto por Bate-Smith e Geissman em razão da cor de ouro apresentada por esses compostos e da semelhança estrutural com as flavonas. As auronas são derivadas de 2-benzilidenocumaranona. A presença de uma ligação olefínica introduz, nessas estruturas, a isomeria geométrica. A maior parte das auronas de origem natural apresentam a configuração Z-olefina, sendo chamadas de Z-auronas (vide tabela 6). Dessa forma, aquelas que possuem a configuração E-olefina, são chamadas E-auronas. A numeração dos substituintes em auronas é feita como na maior parte dos flavonoides, isto é: os números ordinários seguidos de uma linha (‘) atribuídos ao núcleo B e os números ordinários para o núcleo A, contrariamente às chalconas. Uma outra possibilidade de numeração atribui o número 2 para o carbono CH-olefínico, o número 3 para o C-2, 4 para o C-3 e assim sucessivamente. Nessa classificação o C-3a e o C-7a são substituídos pelos números 10 e 9, respectivamente.

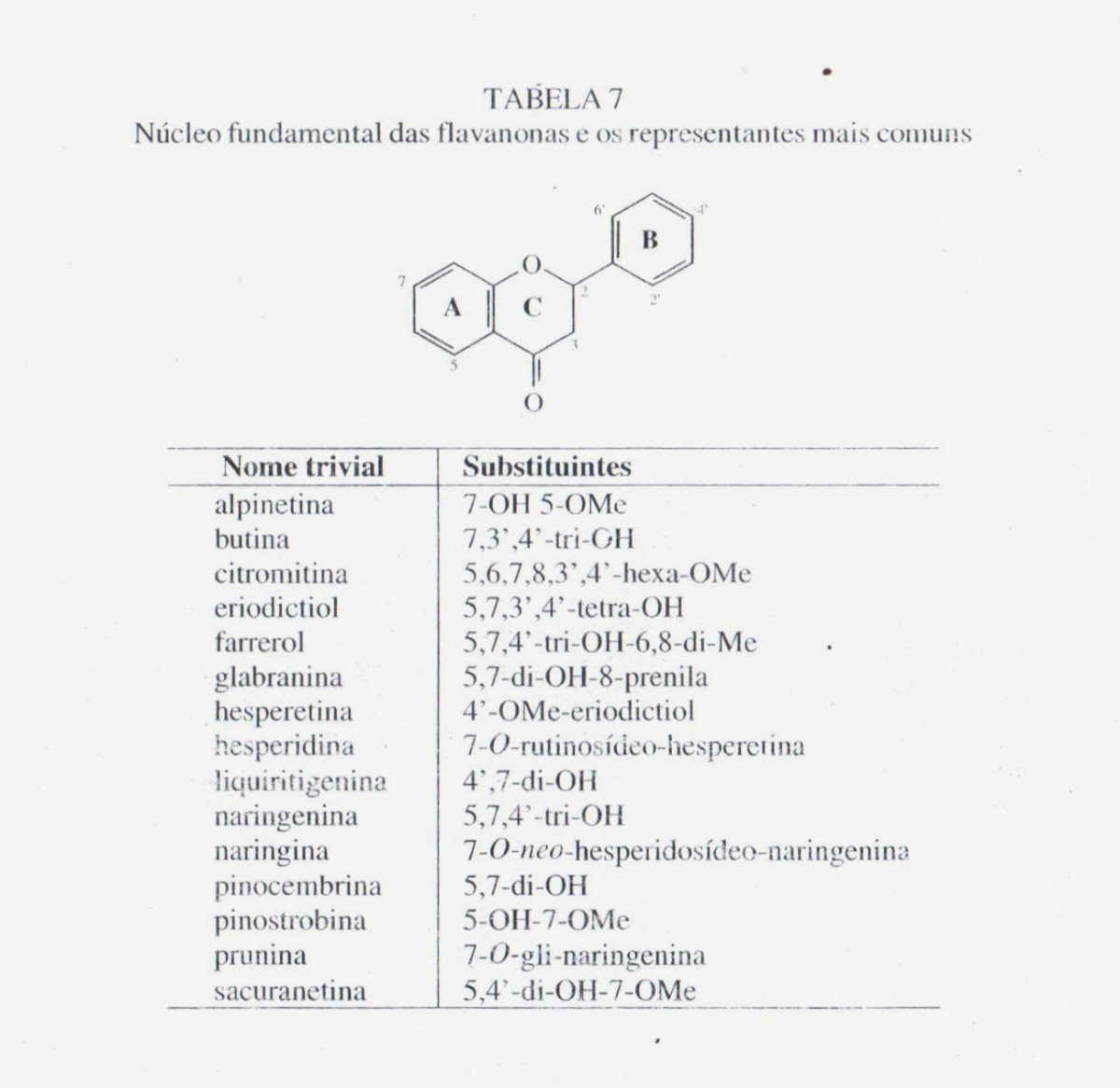
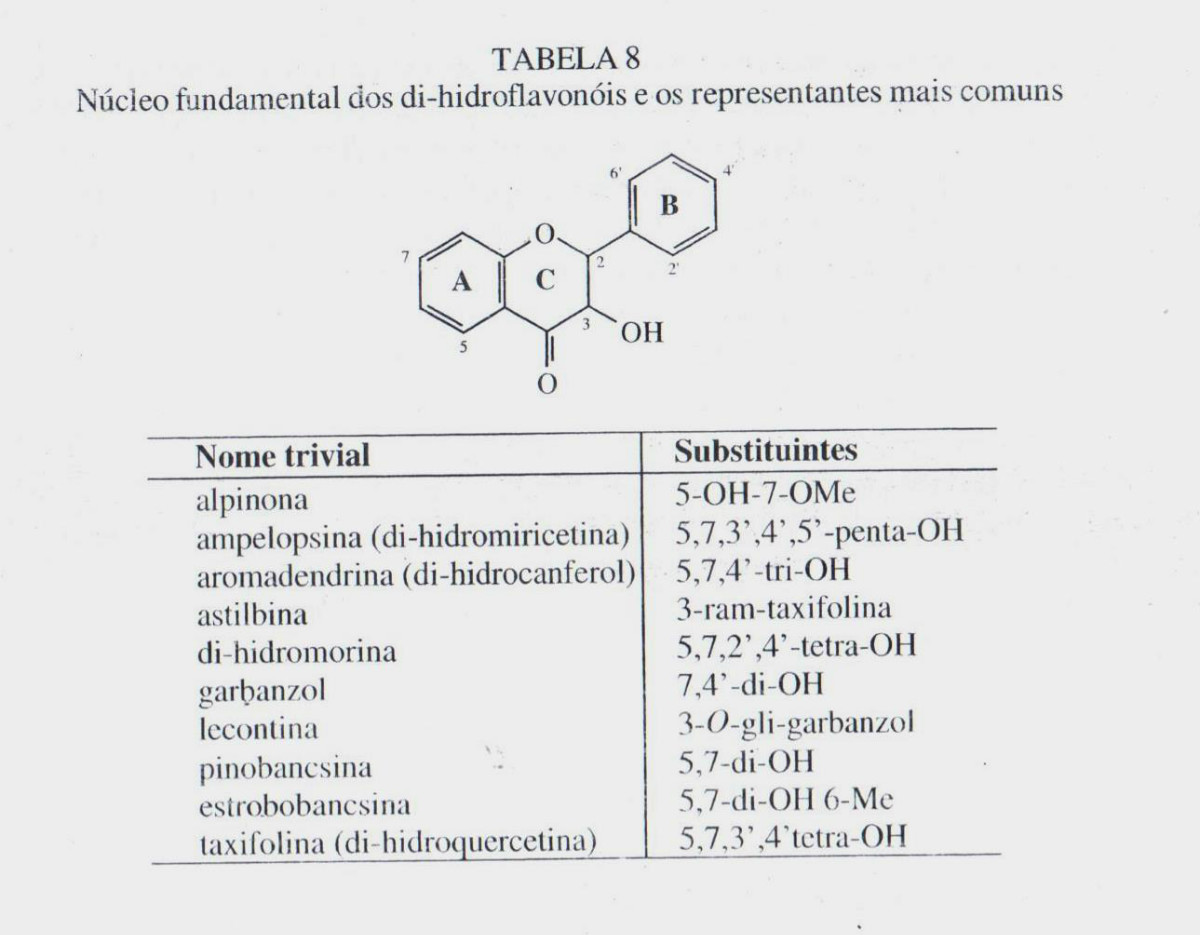
- DI-HIDROFLAVONÓIDES
Os representantes desta classe são: as flavanonas, di-hidroflavonóis e as di-hidrochalconas. Os representantes mais comuns dessa classe estão apresentados nas tabelas 7, 8 e 9. Como características comum, possuem uma ligação simples entre os carbonos 2 e 3 em seu núcleo fundamental, ao contrário das outras classes de flavonoides. A numeração é a mesma de seus isômeros: flavonas, flavonóis e chalconas – vide tabelas 7, 8 e 9, respectivamente. Em consequência, esses flavonoides apresentam centros de assimetria em suas moléculas. Todavia, devido ao fato de terem sido isoladas, em geral, pequenas quantidades dessas substâncias nos vegetais, a estereoquímica é frequentemente omitida em publicações.
- FLAVANAS, LEUCOANTOCIANIDINAS E PROANTOCIANIDINAS
Esses compostos fazem parte de uma classe de flavonoides, junto com os biflavonóides e mais recentemente os isoflavonóides, nos quais é possível encontrar estruturas oligomerizadas. Uma vez que os flavonoides da classe das proantocianidinas também fazem parte de uma das classes de taninos, estas se encontram apresentadas no capítulo “Taninos”.
- ISOFLAVONÓIDES
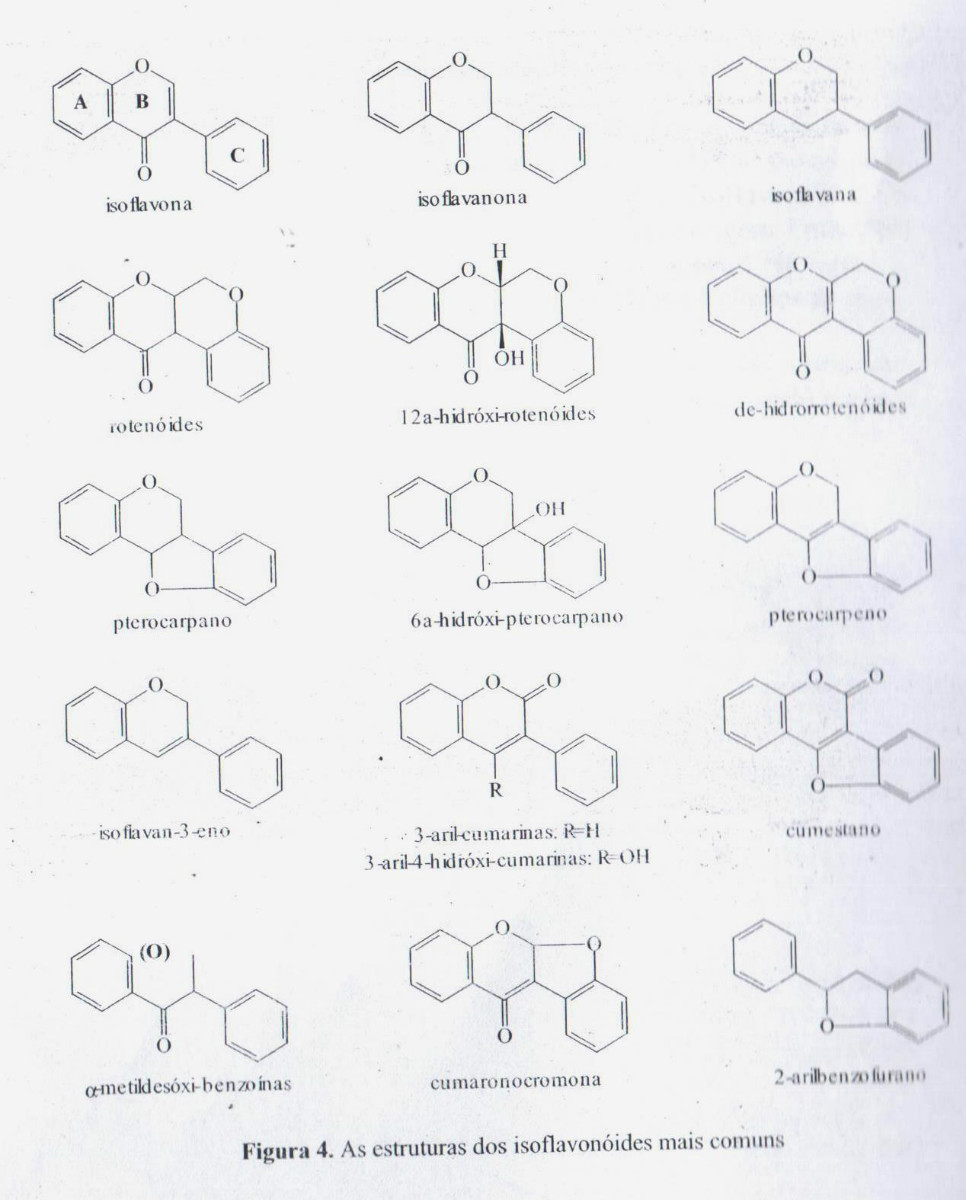
Os isoflavonóides são caracterizados, como os demais flavonoides, por uma cadeia arila-C3-arila, mas do tipo difenil-1,2-propano. Ao contrário das outras classes de flavonoides, sua distribuição taxonômica é restrita. Salvo raríssima exceções, são de ocorrência exclusiva em Fabaceae. Apesar dessa restrição a uma só família botânica, tal classe apresenta uma diversidade estrutural importante: além das isoflavonas, isoflavononas, isoflavenos e aril-3-cumarinas encontram-se estruturas ciclizadas como os pterocarpanos, cumestanos, cumaronocromanas, sendo que algumas possuem um carbono suplementar (rotenóides). Cerca de outras vinte estrutura podem se formar por diferenciação de seu nível de oxidação e variação do núcleo fundamental. Biogeneticamente, os isoflavonóides são formadas, como os demais flavonoides, via chalconas. Em vegetais, uma grande parte dos isoflavonóides comporta-se como fitoalexinas – substâncias produzidas pela planta em resposta a uma infecção por um agente patogênico.
As estruturas principais de isoflavonóides estão apresentadas na figura 4. Os substituintes mais comuns são os grupamentos hidroxila, metoxila e metilenodioxila. São conhecidas muitas isoflavonas substituídascom grupamentos isoprenila. Existem também, com frequência, 5-desóxi-isoflavonóides, assim como moléculas hidroxiladas em posição C-6 e C-2’.
- NEOFLAVONÓIDES
O termo neoflavonóide é empregado para caracterizar um grupo de compostos de origem natural, contendo 15 átomos de carbono, que são associados estruturalmente e biogeneticamente aos flavonoides e isoflavonóides. Os neoflavonóides estão agrupados segundo suas estruturas e origem. Entre eles, os mais abundantes são as 4-arilcumarinas e as dalbergionas. Na figura 5, estão apresentados alguns exemplos de neoflavonóides e classes às quais pertecem.
Apesar do número limitado de estruturas isoladas, aquelas conhecidas têm sido identificadas em diferentes famílias botânicas, diversificando sua presença em vegetais.

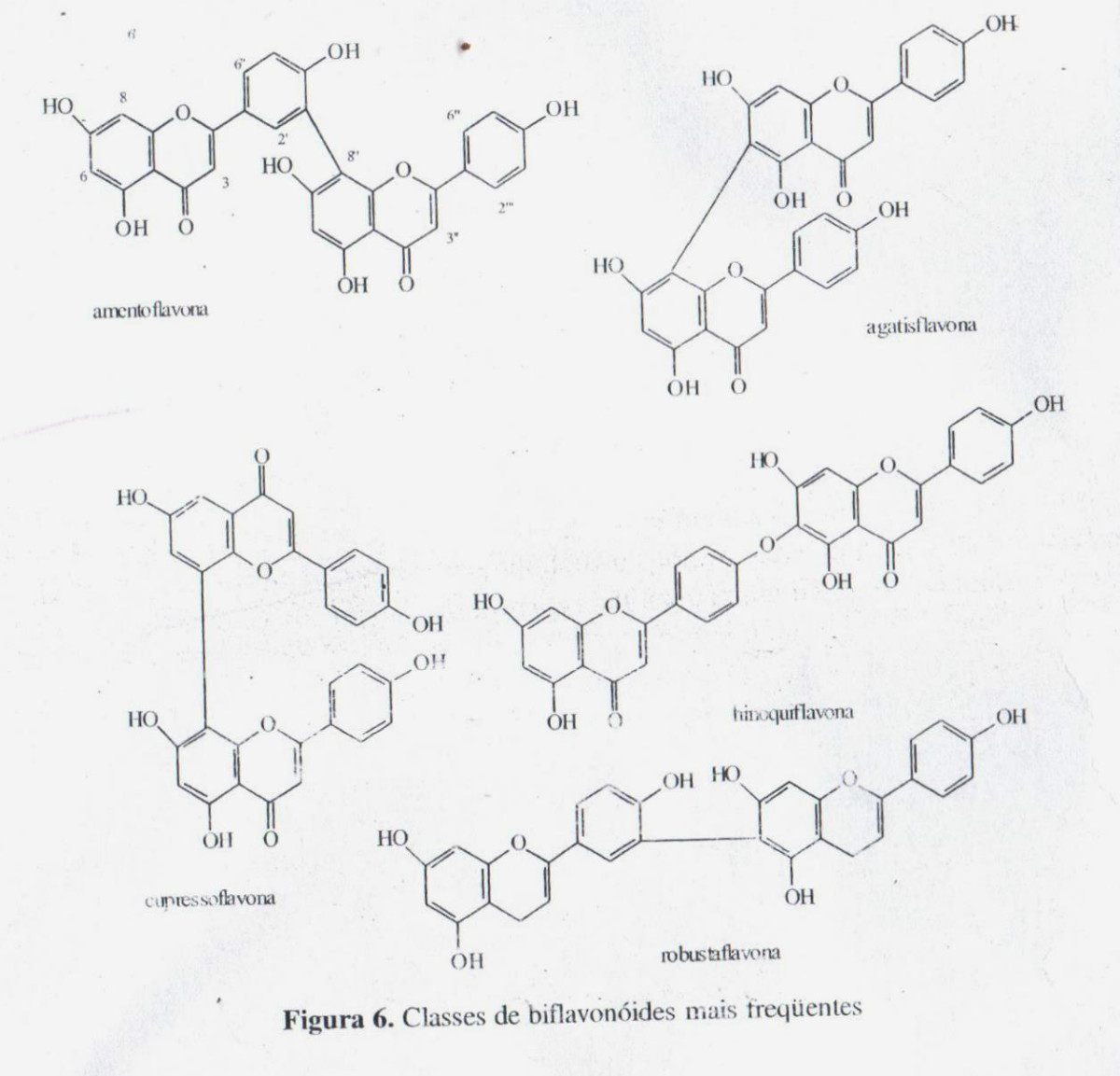
- BIFLAVONÓIDES
Os biflavonóides constituem uma classe de flavonoides diméricos, diferenciando-se de outros oligômeros como as proantocianidinas, devido á sua origem biogenética comum. A maioria dos iflavonóides de ocorrência natural são dímeros de flavonas e flavanonas – raramente chalconas – apresentando substituintes nas posições dos carbonos 5, 7, 4’ e, mais raramente, 5,7,3’, 4’. Os monômeros podem ser iguais ou de diferentes tipos: flavona-flavona, flavanona-flavanona ou flavona-flavanona. Certos grupamentos hidroxilas podem apresentar-se metoxilados. Os heterosídeos são pouco frequentes.
Existem duas maneiras de numerar os biflavonóides. Em uma delas são utilizados números ordinários para os núcleos A e C e os números seguidos de uma linha (‘) para o núcleo B de um dos monômeros (como para as flavonas e flavanonas) e para a segunda unidade monomérica são empregados números ordinários seguidos de duas linhas (“) para os núcleos A e C e números ordinários seguidos de três linhas (’”) para o núcleo B (ver figura 6). Uma seguinte possibilidade é empregar os números romanos I e II para cada monômero seguido da numeração comum de flavonoides, por exemplo I-3, I-4’, II-5, II-2’, etc. Os biflavonóides são classificados segundo o tipo de ligaçãoes entre monômeros e o tipo de núcleo fundamental. A ligação das unidades pode se fazer entre carbono-carbono ou carbono-oxigênio-carbono.
- PROPRIEDADES FÍSICO-QUÍMICAS DOS FLAVONÓIDES
Em geral, as agliconas aparecem sob forma de cristais amarelos. Os heterosídeos são geralmente solúveis em água e em álcoois diluídos, mas insolúveis nos solventes orgânicos habituais, enquanto que as respectivas agliconas são normalmente solúveis em solventes orgânicos apolares e, por possuírem caráter fenólico, em soluções aquosas alcalinas. A posição ocupada pela porção açúcar, o grau de insaturação e o grau e natureza dos substituintes influem grandemente na solubilidade da molécula e na sua capacidade de precipitação em presença de metais.
As flavonas e flavonóis são puco solúveis em água, enquanto os di-hidroflavonóis são mais solúveis. Os 3-hidróxi-flavanos (catequinas) e os 3,4-flavanodióis são solúveis em água, mas o 3-hidróxi-flavano pode ser extraído com éter etílico e os 3,4-flavanodióis com acetato de etila. Os 5-hidróxi-flavonóides podem ser separados com soluções de bórax e os poliglicosídeos são mais solúveis em água e menos solúveis em solventes orgânicos. As antocianinas só são estáveis como sais e convém mantê-las em meio ácido armazenando-as na forma de cloridrato. As chalconas e flavanonas sendo intercambiáveis, exigem cuidado para evitar misturas.
- EXTRAÇÃO DE FLAVONÓIDES
Para extração utilizam-se geralmente solventes com polaridade crescente: a primeira extração, com solvente apolar, retira óleos, gorduras, esteróis e pigmentos facilitando a extração posterior dos flavonoides. A segunda extração com solvente um pouco mais polar (clorofórmio, diclorometano, acetato de etila ou éter etílico) permite recuperar as agliconas livres pouco polares, tais como flavonas, flavonóis, flavanonas, di-hidroflavonóis, isoflavonas e outras agliconas com alto grau de metilação. Aumentando a polaridade do solvente (acetona, metanol, água) se extraem as agliconas poli-hidroxiladas, flavonas e flavonóis mais polares, auronas, chalconas. Por último, a extração com água quente arrastará os heterosídeos mais polares, tais como os poliglicosídeos, flavanodióis, catequinas e procianidinas, e os açúcares. Em meio ácido podem-se extrair antocianinas e antocianidinas.
Na separação de agliconas e heterosídeos de um extrato de álcool etílico, uma alternativa eficiente, após eliminação do solvente, é retomar o extrato com água e proceder a uma extração em funil de separação com um solvente de média polaridade (éter etílico ou diclorometano) para separação das agliconas e, na sequencia, extrair com n-butanol para obtenção dos heterosídeos. Convém salientar que sem estabilização na secagem, as enzimas continuam agindo, podendo levar a um falso teor de heterosídeos.
- CARACTERIZAÇÃO DE FLAVONÓIDES
A caracterização pode ser realizada diretamente no farmacógeno (histoquímica) ou em extratos vegetais, por ensaios cromáticos, cromatográficos, espectroscópicos ou fotométricos. Os ensaios com extrato vegetais são os mais utilizados, pois permitem a avaliação simultânea de vários constituintes.
Uma desvantagem dos ensaios histoquímicos diretos é que muitos polifenóis estão localizados nos vacúolos, podendo assim ocorrer alguma perda de material durante a análise. Mas, no caso de antocianinas, que já são coradas, raramente há dificuldade na sua caracterização in situ, particularmente em flores e folhas estioladas. Flavonoides incolores são um pouco mais difíceis de caracterizar, mas, como ocorrem principalmente em células epidérmicas da superfície superior superior, podem ser rapidamente caracterizados através de suas absorvâncias em UV.
Ensaios cromáticos
Os ensaios cromáticos apresentam importância como estágio preliminar de análise e, em alguns casos, podem ser empregados às dosagens dos respectivos derivados flavônicos. Em alguns casos é possível distinguir entre as diversas classes de flavonoides. As cores obtidas variam conforme o núcleo, o número e a disposição dos substituintes hidroxilados. Dessa forma, os hidróxi-flavonóides reagem a frio com soluções alcalinas, resultando em fenolatos geralmente corados, solúveis em água, mas decomponíveis por ácidos; vapores de amônia mudam a coloração das antocianinas de vermelho para azul e de chalconas e auronas, de laranja para vermelho.
Ensaios cromatográficos
A técnica mais empregada é a cromatografia em camada delgada (CCD), e como adsorvente pode-se utilizar gel de sílica, celulose ou poliamida. As agliconas geralmente são eluídas em sitema n-butanol-ácido acético-água (BAW-diferentes proporções) e os heterosídeos em ácido de 6 a 60%.
Em alguns casos, é preferível cromatografar o extrato vegetal bruto antes mesmo de testar a presença ou ausência de compostos fenólicos, pois muitos podem ser caracterizados diretamente através da observação da absorção ou extinção de fluorescência (no caso de a fase estacionária conter pigmento fluorescente) de radiação ultravioleta de suas manchas nas respectivas cromatoplacas.
- ISOLAMENTO E PURIFICAÇÃO
A separação preliminar de fração fenólica de extratos vegetais pode ser realizada através de reagentes de precipitação como acetato de chumbo, pela extração em meio alcalino seguida da acidificação, ou pela extração em aparelho contínuo de Soxhlet utilizando-se soventes em polaridades crescentes.
Técnicas clássicas de separação como cromatografia em coluna, utilizando poliamida, sephadex LH-20, amberlite ou resina de troca iônica, além de cromatografia em papel, cromatografia circular, cromatografia em camada delgada preparativa, cromatografia líquida de média pressão e cromatografia líquida de alta eficiência (CLMP e CLAE), cromatografia grossa (CG) e recristalização com etanol, metanol ou clorofórmio, quando aplicadas adequadamente, oferecem excelentes resultados.
- DOSEAMENTO DE FLAVONÓIDES
A dosagem conjunta dos flavonoides é dificultada pelo comportamento dos heterosídeos das respectivas agliconas e pela dificuldade de isolamento dessas substâncias de outras classes de fenóis.
Reações de precipitação são muito utilizadas, como a precipitação com cloreto de alumínio em meio alcalino, através da formação de um gel que adsorve os flavonoides permitindo purifica-los por lavagem e centrifugação. Esse precipitado dissolve-se posteriormente em ácido acético adquirindo colorações próprias, permitindo assim, a dosagem colorimétrica.
A partir dos ensaios cromáticos citados anteriormente, pode-se realizar técnicas fotométricas que, quando se dispõe de elementos para montagem de uma curva padrão, é uma técnica rápida e de fácil dosagem. As diferentes técnicas de cromatografia, assim como a eletroforese, também podem ser utilizadas.
- IDENTIFICAÇÃO DE FLAVONÓIDES
A espectroscopia na ultravioleta é a principal técnica tanto para a detecção quanto para o monitoramento da pureza de derivados flavônicos durante os processos de isolamento. Possuem espectros de absorção característicos no ultravioleta, determinados pelo núcleo comum da benzopirona, com dois máximos de absorção: um ocorrendo entre 240-285 nm (banda II) e outro entre 300-400 nm (banda I). Em geral, a banda II pode ser considerada como devida à existência do anel A e a banda I devida ao anel B. Em flavonas a banda I aparece entre 304-350 nm e em flavonóis entre 352-385 nm. Di-hidroflavonóis, flavanonas e isoflavonas exibem uma banda I de baixa intensidade, frequentemente aparecendo como ombro da banda II. As chalconas e auronas apresentam um espectro UV com uma banda I dominante e uma banda II relativamente pequena. Em chalconas observa-se uma banda II com máximos entre 220-270 nm e banda I com máximos entre 340-390 nm, ocorrendo frequentemente um pico entre 300-320 nm. As antocianinas e antocianidinas apresentam uma banda I com máximo de absorção entre 465-550 nm e banda II representada por um sinal de pequena intensidade, ocorrendo entre 270-280 nm. O aumento do grau de hidroxilação do núcleo leva ao aumento do efeito batocrômico e, consequentemente, os espectros deslocam-se no sentido dos maiores comprimentos de onda. A metilação ou esterificação dos grupamentos hidroxila não altera, em geral, os respectivos espectros, exceto na hidroxila características dos flavonóis (em C-3) ou em C-4’, quando se percebe efeito hipsocrômico na banda de maiores comprimentos de onda.
- PROPRIEDADES FARMACOLÓGICAS DOS FLAVONÓIDES
A grande abundância e diversidade dos flavonoides sugerem que eles sejam importantes para as plantas superiores. Contudo não está claro que também o sejam para o homem. De fato, pode-se inferir que os seres humanos ingerem muitos gramas de flavonoides diariamente, sendo encontrados com frequência nas frutas e em muitas outras espécies vegetais, no vinho, em cereais e ocasionalmente em corantes alimentares. Entretanto, não há, até o momento, comprovação evidente de que esses metabólitos sejam imprescindíveis à alimentação humana.
Atividade antiviral
A maioria dos estudos sobre a atividade antiviral de flavonoides tem se restringido ao grupo de flavonas de maior ocorrência, flavonóis, chalconas e seus análogos sintéticos, sendo os heterosídeos considerados menos ativos que as agliconas (Hudson, 1990).
A quercetina tem sido atribuída atividade virucida contra vírus envelopados: vírus herético simples tipo I, vírus respiratório sincicial, pseudoraiva, parainfluenza 3 e sindbis, e ao derivado 3-O-metilado da quercetina foi atribuída atividade contra o vírus da poliomielite, inibindo uma das etapas da replicação viral. As flavonas diosmina e hesperidina inibem a replicação do rotavírus, agente etiológico de diarreias, que são muito frequentes em países de terceiro mundo. (Bae etal., 2000).
Atividade antioxidante
Os flavonoides e outros derivados fenólicos são conhecidos por atuarem na captura e neutralização de espécies oxidantes como o ânion superóxido (O² .), radical hidroxila ou radical peróxido, atuando por sinergismo com outros antioxidantes como as vitaminas C e E. Alguns flavonoides são capazes de se ligar a íons metálicos, impedindo-os de atuarem como catalisadores na produção de radicais livres.
Atividade antiinflamatória
A atividade antiinflamatória desta classe de substância tem sido bastante investigada como os extratos aquoso e hidroetanólico das inflorescências de Achyrocline satureioides (Lam.) DC., Asteraceae. Foi demonstrada atividade no modelo de pata de rato induzido por carragenina, atividade também verificada para os flavonoides quercetina, luteolina e 3-O-metilquercetina, isolados desta espécie vegetal.
Atividade antitumoral
Vários estudos têm relatado o potencial dos flavonoides na quimioterapia preventiva do câncer, e alguns têm demonstrado capacidade de interagir sobre a gênese do câncer, bloqueando o estágio de promoção, através da inibição da síntese da ornitina-descarboxilase. As classes que têm apresentado atividade antitumoral in vitro e em modelos animais como: chalconas, flavanonas, flavanóis, flavonas, flavonóis e isoflavonas. Entre os flavonóis, o galato de epigalocatequina, presente em folhas de Camellia sinensis (L.) Kuntze, mostrou atividade preventiva no modelo animal de câncer duodenal e o mecanismo desta atividade envolve a inibição da liberação do fator de necrose tumoral alfa (TNF-a).
Atividade sobre a permeabilidade capilar
Aos flavonoides rutina e hesperidina têm sido atribuída propriedades protetora capilar ou ação tônico-venosa. Chamadas historicamente de fatores P ou vitamina P, estas substâncias são empregadas no tratamento de enfermidades caracterizadas por hemorragias fragilidade capilar. Assim, especialidades farmacêuticas a base de flavonoides são comercializadas, no Brasil e em países europeus, como medicação para o tratamento de alguns distúrbios circulatórios.
Atividade hormonal
Estudos relatam uma menor incidência de osteoporose em mulheres asiáticas do que em mulheres ocidentais, havendo evidências de que as isoflavonas previnem a fragilidade óssea. A ipriflavona, uma isoflavona sintética, auxilia na manutenção da densidade óssea em mulheres na fase de pré-menopausa e mantém ou mesmo aumenta a densidade óssea em mulheres na fase de pós-menopausa (Knight e Eden, 1995).
No mercado brasileiro, existem especialidades farmacêuticas contendo a ipriflavona para reposição hormonal ou para o tratamento e prevenção da osteoporose, reduzindo a liberação de cálcio ósseo e a reabsorção óssea.
Farmacocinética
Embora a presença de flavonoides na dieta humana seja evidente, ainda existem poucos estudos sobre a capacidade dos mesmos de serem absorvidos e alcançarem seu sítio de ação. A absorção por via oral destas substâncias ainda não está clara. Para certos autores, após administração oral, a quercetina não é detectada no plasma e nem na urina, seja in natura ou sob a forma de metabólitos, o que exclui a absorção destas substância em quantidade superior a 1% (Ferry et al., 1996; Gugler et al., 1975).
Toxicidade de flavonoides
Os flavonoides, normalmente não são considerados substâncias tóxicas e várias especialidades farmacêuticas os descrevem como insetos de toxidade. Todavia, não há atualmente respaldo na literatura científica para isentálos.
- DROGAS VEGETAIS CLÁSSICAS
Diversos vegetais empregados na medicina popular têm ações atribuídas à presença de flavonoides. Alguns experimentos farmacológicos justificam essas afirmações. Todavia, é importante sublinhar que a quase totalidade dos vegetais possuem algum tipo de flavonóide, tornando difícil em muitos casos atribuir-lhes exclusivamente a responsabilidade de uma atividade farmacológica específica. A seguir, são citados exemplos de drogas vegetais empregadas em terapêutica com teor significativo de flavonoides.
CITROS
Família botânica: Rutaceae
Os cítricos são árvores de origem oriental, cultivados pelo seus frutos. Existem inúmeras espécies, variedades e híbridos do Gênero Citrus, além de alguns gêneros afins. Muito utilizados devido ao seu teor em óleo volátil, são também fontes de pectinas e flavonoides.
MARACUJÁ
Nome científico: Passiflora alata Curtis e Passiflora edulis Sims
Família botânica: Passifloraceae
Parte utilizada: folhas e partes aéreas
As folhas secas de maracujá são empregadas como sedativo, embora os responsáveis por essa atividade não sejam conhecidos com clareza. Dessa forma, emprega-se o total dos constituintes das folhas do vegetal. Diversas espécies são conhecidas em todo o Brasil, sendo Passiflora edulis Sims e Passiflora alata Curtis as mais cultivadas.
REFERENCIAS
SIMEÕES, CM, SCHENKEL, EP.: GOSMANN, G,.: MELO, J.C.P. Farmacognosia: da planta ao medicamento. 6ª Ed. Porto Alegre: Ed da UFRGS/ Florianópolis: Ed. Da UFSC, 2007. 1104p.







